
Δρ.
Ζουριδάκης Μάριος
(ανεξάρτητη ομάδα από τον Σεπτέμβριο 2021)
Η ερευνητική μας ομάδα ανήκει στο Εργαστήριο Μοριακής Νευροβιολογίας και Ανοσολογίας και δραστηριοποιείται στο χώρο της Δομικής Βιολογίας πρωτεϊνών φαρμακολογικού ενδιαφέροντος.
Το επίκεντρο του ερευνητικού μας ενδιαφέροντος είναι η αποκρυπτογράφηση της κρυσταλλικής δομής διαφόρων πρωτεϊνών φαρμακολογικού ενδιαφέροντος καθώς και των δομών τους με διάφορους προδέτες (πχ. χημικά μόρια, πεπτίδια) ή/και με αντισώματα που αποτελούν εν δυνάμει φάρμακα για την θεραπεία σχετικών ασθενειών. Επιπλέον, μεγάλο ενδιαφέρον παρουσιάζει η αποκρυπτογράφηση των λειτουργικών μηχανισμών των υπό μελέτη πρωτεϊνικών μορίων μέσω δομο-επαγώμενης μεταλλαξογένεσης και επακόλουθων λειτουργικών δοκιμασιών. Επίσης, σε συνεργασία με άλλα μέλη του Εργαστηρίου Μοριακής Νευροβιολογίας και Ανοσολογίας, ορισμένες από τις ανασυνδυασμένες πρωτεΐνες που χρησιμοποιούνται για δομικές μελέτες χρησιμεύουν ως αντιγόνα για την ανάπτυξη διαγνωστικών δοκιμασιών.
Κύρια ερευνητικά ενδιαφέροντα της ομάδας:
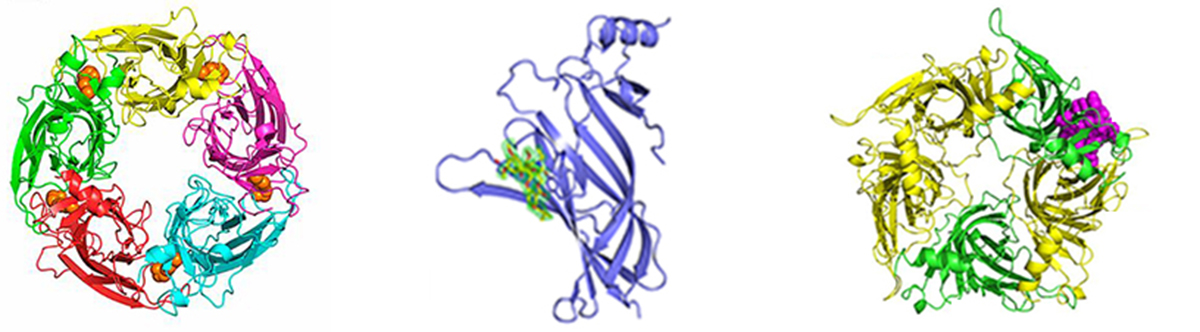
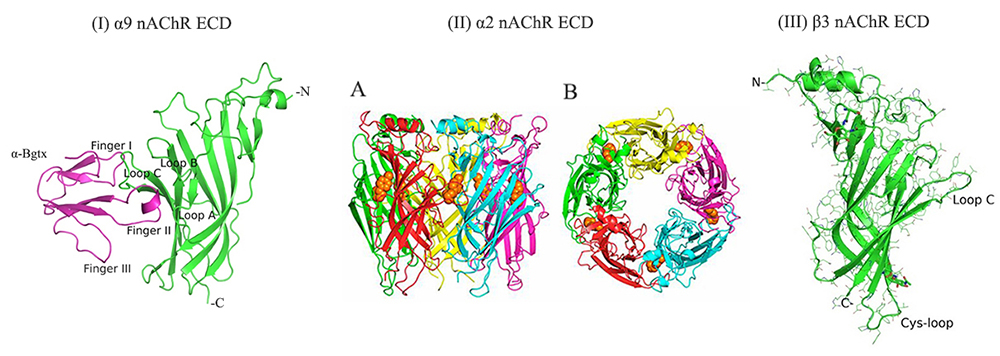
Δομικές μελέτες ιοντικών καναλιών ενεργοποιούμενων από προσδέτη. Ένας κύριος στόχος μας για την αποσαφήνιση της τρισδιάστατης δομής του είναι οι ανθρώπινοι νευρωνικοί νικοτινικοί υποδοχείς ακετυλοχολίνης (nAChRs). Οι νευρωνικοί nAChRs ρυθμίζουν τη νευρωνική διεγερσιμότητα και την απελευθέρωση νευροδιαβιβαστών του Κεντρικού Νευρικού Συστήματος. Συγκροτούν διάφορους υπότυπους πενταμερών μορίων που προκύπτουν από συνδυασμούς μεταξύ έντεκα υπομονάδων (α2-α7, α9, α10, β2-β4), καθένας με διακριτές φαρμακολογικές και ηλεκτροφυσιολογικές ιδιότητες. Είναι υπεύθυνοι για τον εθισμό στη νικοτίνη και εμπλέκονται σε πολλές νευρολογικές ασθένειες και διαταραχές (π.χ. Αλτσχάϊμερ και Πάρκινσον, αυτισμός, σχιζοφρένεια). Είναι ενδιαφέρον ότι διάφοροι νευρωνικοί nAChRs (π.χ. α7, α9, α10) υπάρχουν επίσης και εκτός του νευρικού συστήματος, όπως σε κύτταρα του ανοσοποιητικού συστήματος, κύτταρα μαστού και πνεύμονα, κερατινοκύτταρα, κ.λπ., όπου έχει βρεθεί ότι παίζουν σημαντικό ρόλο στη φλεγμονή και σε διάφορους τύπους καρκίνου. Η αποσαφήνιση της δομής των νευρωνικών nAChRs στις ελεύθερες μορφές τους καθώς και σε σύμπλοκα με προσδέτη απαιτείται για το σχεδιασμό ειδικών φαρμάκων έναντι των διφορετικών υποτύπων και για την κατανόηση των λειτουργικών μηχανισμών τους. Επίσης, στα ενδιαφέροντά μας εμπίπτουν και δομικές μελέτες του ανθρώπινου μυϊκούς nAChR (το αυτοαντιγόνο στη νόσο της μυασθένειας gravis) με νέες νευροτοξίνες και περιοχές Fab μονοκλωνικών αντισωμάτων.
Δομικές μελέτες του υποδοχέα ACE2. Ορμώμενη από την πανδημία COVID-19, η ομάδα έχει ξεκινήσει προσπάθειες για την αποσαφήνιση των κρυσταλλικών δομών του ανθρώπινου υποδοχέα του μετατρεπτικού ενζύμου αγγειοτενσίνης 2 (ACE2), που αποτελεί το σημείο εισόδου του SARS-CoV2 στα κύτταρα, με τα σύμπλοκά του με τις περιοχές πρόσδεσης (RBD) της πρωτεϊνης ακίδας του κορωνοϊού. Οι μελέτες αυτές διεξάγονται με ανασυνδυασμένα μόρια RBDs τόσο του αρχικού στελέχους που εμφανίστηκε στη Wuhan, όσο και των αναδυόμενων μεταλλαγμένων στελεχών. Επιπλέον, η ομάδα ενδιαφέρεται για δομικές μελέτες των υποδοχέων ACE2 και ACE με νέους αναστολείς προκειμένου να παράσχει τη δομική βάση για το σχεδιασμό νέων προσδεμάτων (αναστολέων ή ενισχυτών) του Συστήματος Ρενίνης-Αγγειοτενσίνης-Αλδοστερόνης (RAAS) για τη ρύθμιση της αρτηριακής πίεσης και της ισορροπίας των υγρών του οργανισμού. Επιπρόσθετα, η ομάδα παρέχει τις ανασυνδυασμένες RBD και ACE2 πρωτεΐνες σε άλλα μέλη του Εργαστηρίου για την ανάπτυξη διαγνωστικών τεστ ανίχνευσης αντισωμάτων σε εμβολιασμένους και νοσούντες.
Δομικές μελέτες Τυροσινάσης. Η τυροσινάση είναι ένα μεταλλο-ένζυμο ευρέως κατανεμημένο σε διαφορετικούς οργανισμούς και παίζει σημαντικό ρόλο στη μελανογένεση και την ενζυμική αμαύρωση. Η υπερμελάγχρωση στο ανθρώπινο δέρμα καθώς και το μαύρισμα φρούτων, λαχανικών και μυκήτων είναι συχνές ανεπιθύμητες ενέργειες που σχετίζονται με τις τυροσινάσες. Η ομάδα μας ενδιαφέρεται να μελετήσει δομικά και λειτουργικά τόσο τις τυροσινάσες του ανθρώπου όσο και των μανιταριών. Αναμένουμε ότι οι μελέτες μας θα αποκαλύψουν τα μοναδικά δομικά χαρακτηριστικά αυτών των ενζύμων και θα βοηθήσουν στην ανάπτυξη νέων, ισχυρών και εκλεκτικών αναστολέων. Αυτά τα μόρια μπορούν να είναι ελκυστικά στις βιομηχανίες καλλυντικών και φαρμάκων ως παράγοντες αποχρωματισμού καθώς και στις βιομηχανίες τροφίμων και γεωργίας ως ενώσεις κατά του ανεπιθύμητου μαυρίσματος διάφορων φυσικών βρώσιμων προϊόντων.
Λειτουργικές μελέτες υποδοχέων και ενζύμων. Η ομάδα ενδιαφέρεται να συμπληρώσει τα δομικά της ευρήματα με λειτουργικές μελέτες. Για τους nAChRs, η ομάδα μελετά τις φαρμακολογικές τους ιδιότητες και την επίδραση νέων προσδεμάτων με πειράματα δέσμευσης σημασμένων προσδετών και με την τεχνική παγίδευσης τάσης δύο ηλεκτροδίων, ενώ για το ένζυμο ACE2 η ομάδα μελετά την επίδραση δυνητικά νέων αναστολέων (ή ενισχυτών) με κλασικές μελέτες κινητικής. Επίσης, μεγάλο ενδιαφέρον παρουσιάζει η ανακάλυψη αυτοαντισωμάτων κατά των νευρωνικών nAChR σε αρκετές παθήσεις του νευρικού συστήματος όπως σχιζοφρένεια, διπολικές διαταραχές, επιληψία κ.λπ., σε συνεργασία με την άλλη ερευνητική ομάδα του εργαστηρίου και με εξωτερικούς συνεργάτες.
Καθηγητής Δημήτρης Γεωργιάδης, ΕΚΠΑ
Καθηγητής Γεώργιος Σπυρούλιας, Παν. Πατρών
Καθηγητής Γεώργιος Βουγιουκαλάκης, ΕΚΠΑ
Αν. Καθηγητής Κώστας Μπεθάνης, Γεωπονικό Πανεπιστήμιο Αθηνών
Αν. Καθηγητής Ευστράτιος Στρατίκος, ΕΚΠΑ
Δρ. Σπύρος Ζωγράφος, Εθνικό Ίδρυμα Ερευνών
Dr Uwe Maskos, Institut Pasteur, Paris
Dr Friederike Jonsson, Institut Pasteur, Paris
Prof. Chris Ulens, KU, Leuven, Belgium
Prof. Victor Tsetlin, Russian Academy of Sciences, Russia
Prof. Michael McIntosh, University of Utah, USA
- Institut Pasteur, Paris, Transversal Research programs (PTR): Role of human auto-antibodies against nicotinic acetylcholine receptors in psychiatric disease PTR no 695 – 2023 Anti-NIC (Ρόλος M.Z.: Ε.Υ. για το Ελληνικό Ινστιτούτο Παστέρ) 01/01/2024-31/12/2025
- Γ.Γ.Ε.Κ., Εμβληματική Δράση «ΤΑΑ TAEDR-0535850» με τίτλο: «Εθνικό δίκτυο έρευνας για την ανάδειξη της γενετικής βάσης των νευροεκφυλιστικών νόσων Alzheimer και Parkinson, την ανίχνευση αξιόπιστων βιοδεικτών και την ανάπτυξη καινοτόμων υπολογιστικών τεχνολογιών και θεραπευτικών στρατηγικών στη βάση της ιατρικής ακρίβειας», Ελλάδα 2.0, Εθνικό Σχέδιο Ανάκαμψης και Ανθεκτικότητας (Ρόλος Μ.Ζ.: E.Y. ενοτήτων εργασίας) 15/05/2023-14/09/2025
- Hellenic Foundation for Research and Innovation (HFRI) Project, Structural and functional studies of nicotinic acetylcholine receptors, StruNic, code number 677, 2018-2022
- Stavros Niarchos Foundation, Development of innovative biological products 2016-2020
Ridgway H, Moore GJ, Gadanec LK, Zulli A, Apostolopoulos V, Hoffmann W, Węgrzyn K, Vassilaki N, Mpekoulis G, Zouridakis M, Giastas P, Vidali VP, Kelaidonis K, Matsoukas MT, Dimitriou M, Mavromoustakos T, Tsiodras S, Gorgoulis VG, Karakasiliotis I, Chasapis CT, Matsoukas JM. (2024) Novel benzimidazole angiotensin receptor blockers with anti-SARS-CoV-2 activity equipotent to that of nirmatrelvir: computational and enzymatic studies. Expert Opin Ther Targets 2024 May;28(5):437-459. doi: 10.1080/14728222.2024.2362675
Kokkorakis N, Zouridakis M, Gaitanou M. (2024) Mirk/Dyrk1B Kinase Inhibitors in Targeted Cancer Therapy. Pharmaceutics 2024 Apr 11;16(4):528. doi: 10.3390/pharmaceutics16040528
Darrau E, Jacquemet E, Pons S, Schlick L, Zouridakis M, Wu CL, Richard JR, Barau C, Le Corvoisier P, Yolken R, Tamouza R, Leboyer M, Maskos U. (2024) Serum autoantibodies against α7-nicotinic receptors in subgroups of patients with bipolar disorder or schizophrenia: clinical features and link with peripheral inflammation. Transl Psychiatry 2024 Mar 14;14(1):146. doi: 10.1038/s41398-024-02853-8
Giastas P, Papakyriakou A, Tsafaras G, Tzartos SJ & Zouridakis M. (2022) Structural Insights into the Role of β3 nAChR Subunit in the Activation of Nicotinic Receptors. Molecules. 2022;27(14):4642 doi: 10.3390/molecules27144642
Michail M, Zouvelou V, Belimezi M, Haroniti A, Zouridakis M & Zisimopoulou P. (2022) Analysis of nAChR Autoantibodies Against Extracellular Epitopes in MG Patients. Front Neurol. 2022;13:858998. doi: 10.3389/fneur.2022.858998.
Lebedev, D.S., Kryukova, E.V., Ivanov, I.A., Egorova, N.S., Timofeev, N.D., Spirova, E.N., Tufanova, E.Yu., Siniavin, A.E., Kudryavtsev, D.S., Kasheverov, I.E., Zouridakis, M., Katsarava, R., Zavradashvili, N., Iagorshvili, I., Tzartos, S.J., & Tsetlin, V.I. (2019) Oligoarginine Peptides, a New Family of Nicotinic Acetylcholine Receptor Inhibitors. Mol Pharmacol. 2019;96(5):664-673. doi:10.1124/mol.119.117713
Giastas P, Mpakali A, Papakyriakou A, Lelis A, Kokkala P, Neu M, Rowland P, Liddle J, Georgiadis D, Stratikos E. (2019) Mechanism for antigenic peptide selection by endoplasmic reticulum aminopeptidase 1. Proc Natl Acad Sci U S A. 2019 Dec 26;116(52):26709-26716. doi: 10.1073/pnas.1912070116.
Zouridakis, M., Papakyriakou, A., Ivanov, I.A., Kasheverov, I.E., Tsetlin, V., Tzartos, S., & Giastas, P. (2019) Crystal Structure of the Monomeric Extracellular Domain of α9 Nicotinic Receptor Subunit in Complex With α-Conotoxin RgIA: Molecular Dynamics Insights Into RgIA Binding to α9α10 Nicotinic Receptors. Front Pharmacol.2019;10:474. doi:10.3389/fphar.2019.00474
Giastas P, Andreou A, Papakyriakou A, Koutsioulis D, Balomenou S, Tzartos SJ, Bouriotis V, Eliopoulos EE. (2018)Structures of the Peptidoglycan N-Acetylglucosamine Deacetylase Bc1974 and Its Complexes with Zinc Metalloenzyme Inhibitors. Biochemistry. 2018 Feb 6;57(5):753-763. doi: 10.1021/acs.biochem.7b00919. Epub 2018 Jan 5. PMID: 29257674.
Kryukova, E. V., Ivanov, I. A., Lebedev, D. S., Spirova, E. N., Egorova, N. S., Zouridakis, M., Kasheverov, I. E., Tzartos, S. J., & Tsetlin, V. I. (2018) Orthosteric and/or Allosteric Binding of α-Conotoxins to Nicotinic Acetylcholine Receptors and Their Models. Mar Drugs. 2018;16(12):460. doi:10.3390/md16120460
Giastas P, Zouridakis M & Tzartos SJ¶ (2018) Understanding structure-function relationships of the human neuronal acetylcholine receptor: insights from the first crystal structures of neuronal subunits. Br J Pharmacol.2018;175(11):1880-1891. doi:10.1111/bph.13838
Vulfius CA, Kasheverov IE, Kryukova EV, Spirova EN, Shelukhina IV, Starkov VG, Andreeva TV, Faure G, Zouridakis M, Tsetlin VI, & Utkin YN (2017) Pancreatic and snake venom presynaptically active phospholipases A2 inhibit nicotinic acetylcholine receptors. PLoS One. 2017;12(10):e0186206. doi:10.1371/journal.pone.0186206
Lykhmus O, Koval L, Pastuhova D, Zouridakis M, Tzartos S, Komisarenko S, & Skok M (2016) The role of carbohydrate component of recombinant α7 nicotinic acetylcholine receptor extracellular domain in its immunogenicity and functional effects of resulting antibodies. Immunobiol. 2016;221(12):1355-1361. doi:10.1016/j.imbio.2016.07.012
Lykhmus O, Gergalova G, Zouridakis M, Tzartos S, Komisarenko S & Skok M (2015) Inflammation decreases the level of alpha7 nicotinic acetylcholine receptors in the brain mitochondria and makes them more susceptible to apoptosis induction. Int Immunopharmacol. 2015;29(1):148-151. doi:10.1016/j.intimp.2015.04.007
Lykhmus O, Voytenko L, Koval L, Mykhalskiy S, Kholin V, Peschana K, Zouridakis M, Tzartos S, Komisarenko S & Skok M (2015) α7 Nicotinic Acetylcholine Receptor-Specific Antibody Induces Inflammation and Amyloid β42 Accumulation in the Mouse Brain to Impair Memory. PLoS One. 2015;10(3):e0122706. doi:10.1371/journal.pone.0122706
Azam L, Papakyriakou A, Zouridakis M, Giastas P, Tzartos SJ, & McIntosh JM (2015) Molecular interaction of α-conotoxin RgIA with the rat α9 nAChR. Mol Pharmacol. 2015;87(5):855-864. doi:10.1124/mol.114.096511
Zouridakis M, Giastas P, Zarkadas E, Chroni-Tzartou D, Bregestovski P, & Tzartos SJ (2014) Crystal structures of free and antagonist-bound states of human α9 nicotinic receptor extracellular domain. Nat Struct Mol Biol.2014;21(11):976-980. doi:10.1038/nsmb.2900
Niarchos A, Zouridakis M, Douris V, Georgostathi A, Kalamida D, Sotiriadis A, Poulas K, Iatrou K, & Tzartos SJ (2013)Expression of a highly antigenic and native-like folded extracellular domain of the human α1 subunit of muscle nicotinic acetylcholine receptor, suitable for use in antigen specific therapies for Myasthenia Gravis. PLoS One.2013;8(12):e84791. doi:10.1371/journal.pone.0084791
Koval L, Lykhmus O, Kalashnyk O, Bachinskaya N, Kravtsova G, Soldatkina M, Zouridakis M, Stergiou C, Tzartos S,Tsetlin V, Komisarenko S, & Skok M (2011) The presence and origin of autoantibodies against α4 and α7 nicotinic acetylcholine receptors in the human blood: possible relevance to Αlzheimer's pathology. J Alzheimers Dis.2011;25(4):747-761. doi:10.3233/JAD-2011-101845
Lykhmus O, Koval L, Skok M, Zouridakis M, Zisimopoulou P, Tzartos SJ, Tsetlin V, Granon S, Changeux JP, Komisarenko S & Cloëz-Tayarani I (2011) Antibodies against extracellular domains of alpha4 and alpha7 subunitsalter the levels of nicotinic receptors in the mouse brain and affect memory: possible relevance to Alzheimer'spathology. J Alzheimers Dis. 2011;24(4):693-704. doi:10.3233/JAD-2011-101842
Lykhmus O, Koval L, Pavlovych S, Zouridakis M, Zisimopoulou P, Tzartos S, Tsetlin V, Volpina O, Cloëz-Tayarani I, Komisarenko S & Skok M (2010) Functional effects of antibodies against non-neuronal nicotinic acetylcholine receptors. Immunol Lett. 2010;128(1):68-73. doi:10.1016/j.imlet.2009.11.006
Zouridakis M, Zisimopoulou P, Poulas K & Tzartos SJ (2009) Recent advances in understanding nicotinic acetylcholine receptor structure. IUBMB Life. 2009;61(4):407-423. doi:10.1002/iub.170
Zouridakis M, Zisimopoulou P, Eliopoulos E, Poulas K & Tzartos SJ (2009) Design and expression of human α7 nicotinic acetylcholine receptor extracellular domain mutants with enhanced solubility and ligand-binding properties Biochim Biophys Acta. 2009;1794(2):355-366. doi:10.1016/j.bbapap.2008.11.002
Zouridakis M, Kostelidou K, Sotiriadis A, Stergiou C, Eliopoulos E, Poulas K & Tzartos SJ (2007) Circular dichroismstudies of extracellular domains of human nicotinic acetylcholine receptors provide an insight into their structure. Int J Biol Macromol. 2007;41(4):423-429. doi:10.1016/j.ijbiomac.2007.05.012
Kalamida D, Poulas K, Avramopoulou V, Fostieri E, Lagoumintzis G, Lazaridis K, Sideri A, Zouridakis M & Tzartos SJ. (2007) Muscle and neuronal nicotinic acetylcholine receptors. Structure, function and pathogenicity. FEBS J. 2007;274(15):3799-3845. doi:10.1111/j.1742-4658.2007.05935.x
Kostelidou K, Trakas N, Zouridakis M, Bitzopoulou K, Sotiriadis A, Gavra I & Tzartos SJ (2006) Expression and characterisation of soluble forms of the extracellular domains of the β, γ and ε subunits of the human muscle acetylcholine receptor. FEBS J. 2006;273(15):3557-3568. doi:10.1111/j.1742-4658.2006.05363.x





