

Η Μονάδα Βιοαπεικόνισης (ΜΒ) του Ελληνικού Ινστιτούτου Παστέρ (ΕΙΠ) είναι μία από τις πιο σύγχρονες και άρτια εξοπλισμένες απεικονιστικές μονάδες Μικροσκοπίας στην Ελλάδα. Η Μονάδα είναι μέλος της Ευρωπαϊκής Πρωτοβουλίας Οπτικής Μικροσκοπίας (European Light Microscopy Initiative, ELMI) και του BioImaging.GR consortium. Επιπλέον, η Μονάδα αποτελεί μια πλατφόρμα ανοιχτής πρόσβασης, που στοχεύει να παρέχει προηγμένες υπηρεσίες και «εργαλεία» Οπτικής Μικροσκοπίας και ανάλυσης εικόνας στους επιστήμονες του ΕΙΠ καθώς και σε επιστήμονες από εθνικά και διεθνή ερευνητικά ιδρύματα και Πανεπιστήμια.
Η ΜΒ έχει αναπτύξει συνεργασίες με κορυφαίες ομάδες απεικόνισης στην ΕΕ και με το Institut Pasteur Paris (Image Analysis hub platform, Biological Image Analysis Unit- Icy), οι οποίες έχουν συμβάλει στην ανάπτυξη καινοτόμων τεχνολογιών απεικόνισης και ανάλυσης εικόνας στη ΜΒ. Επιπλέον, ευρωπαϊκές και εθνικές επιχορηγήσεις όπως BIOIMAGING-GR – Υποτροφία Υπουργείου Παιδείας για Υποδομές (2017-2020), Χορήγηση Ιδρύματος Σταύρος Νιάρχος: (2016-2020), KRHPIS I-II (2015-2018) και το Πρόγραμμα FP7 ΕΕ NEUROSIGN (2010-2013) έχουν υποστηρίξει τη σημαντική αναβάθμιση της ΜΒ. Η ΜΒ είναι ο κόμβος της Intravital Imaging 2 φωτονίων στο Bioimaging-GR Consortium, καθώς και της γρήγορης απεικόνισης ζωντανών κυττάρων.
Οι κύριες μεθοδολογίες αιχμής που εφαρμόζονται στη ΜΒ είναι:
- intravital απεικόνιση 2 φωτονίων στον φλοιό του εγκεφάλου διαγονιδιακών ποντικών,
- απεικόνιση ζωντανών κυττάρων βραχείας και μεγάλης διάρκειας και
- ανάλυση εικόνας με χρήση εμπορικά διαθέσιμου και/ή ανοιχτής πρόσβασης λογισμικού ανάλυσης εικόνας.
Η ΜΒ έχει αναδειχθεί μέσω του Διεθνούς Δικτύου Ινστιτούτου Παστέρ ως κόμβος για προηγμένη εκπαίδευση απεικόνισης και επιστημονικές συνεργασίες. Επιπλέον, η ΜΒ έχει διοργανώσει εκπαιδευτικές δραστηριότητες, ενώ δημοσιεύσεις με συμμετοχή ή αναγνώριση της ΜΒ έχουν δημοσιευθεί σε διεθνή περιοδικά.
Στρατηγικός στόχος μας είναι να αναπτύξουμε τα κατάλληλα εργαλεία και την τεχνολογία που θα μας επιτρέψουν να παρακολουθούμε σε πραγματικό χρόνο την εξέλιξη της νόσου σε ένα ευρύ φάσμα μοντέλων μεταδοτικών και μη μεταδοτικών ασθενειών, να αναπτύξουμε απεικόνιση ιόντων ασβεστίου σε ζωντανά κύτταρα, καθώς και πολύ-παραμετρική απεικόνιση middle-throughput και high-throughput.
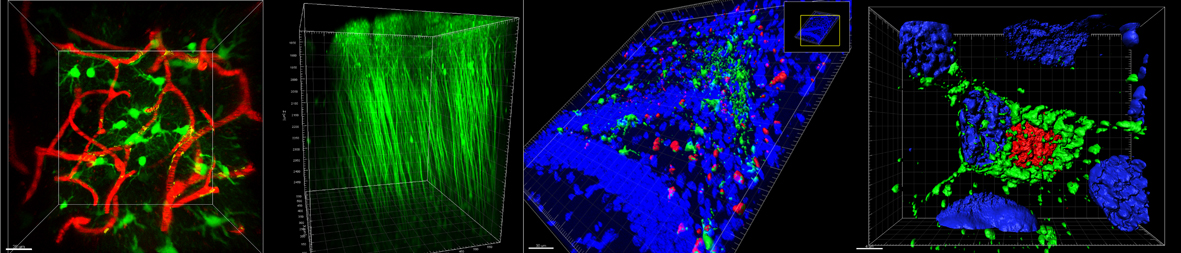
Η ΜΒ είναι εξοπλισμένη με δύο Συνεστιακά Μικροσκόπια, το ένα εκ των οποίων λειτουργεί και ως πολυφωτονικό και ένα μικροσκόπιο ευρέως πεδίου «Time lapse» με δυνατότητα βιντεοσκόπισης ζωντανών κυττάρων. Τα μικροσκόπια χρησιμοποιούνται ευρέως από τους επιστήμονες του ΕΙΠ για μελέτες στους τομείς της Μικροβιολογίας, Ανοσολογίας, Κυτταρικής Βιολογίας και Νευροβιολογίας, που επιτρέπουν την ανίχνευση του συνεντοπισμού μορίων σε κυτταρικό και υποκυτταρικό επίπεδο και απεικόνιση ζωντανών κυττάρων, ιστών και ολόκληρων πειραματοζώων σε 4D και 5D. Ειδικά το σύστημα πολυφωτονικής μικροσκοπίας επιτρέπει απεικόνιση δυναμικών κυτταρικών αλληλεπιδράσεων, που συμβαίνουν σε μεγάλο βάθος μέσα στους ιστούς των πειραματοζώων. Ο εξοπλισμός της ΜΒ είναι διαθέσιμος για χρήση από εξωτερικούς χρήστες από άλλα ερευνητικά ιδρύματα και πανεπιστήμια.
Οι εφαρμογές μικροσκοπίας που πραγματοποιούνται στη Μονάδα είναι:
- Πολυχρωματική τρισδιάστατη απεικόνιση (3D imaging)
- Απεικόνιση ζωντανών κυττάρων μακράς διάρκειας (long time in vivo time-lapse experiments)
- Πολυφωτονική μικροσκοπία (2-photon microscopy)
- Απεικόνιση νευρικού συστήματος ζωντανών πειραματοζώων (Intravital imaging)
- Δεύτερη αρμονική απεικόνιση (second harmonic imaging)
- Μελέτες συνεντοπισμού μορίων σε κύτταρα/ιστούς
- Παρακολούθηση σωματιδίων (particle tracking)
- Απεικόνιση ιόντων ασβεστίου (Calcium imaging)
- Μικροσκοπία αντίθεσης φάσης (Phase contrast)
- Μικροσκοπία αντίθεσης διαφορικής συμβολής (DIC-Nomarski)
- Μέθοδοι ανάλυσης και ποσοτικοποίησης ψηφιακής εικόνας με τα προγράμματα ανάλυσης εικόνας ImageJ/Fiji, αυτοματοποιημένες αναλύσεις με macro, Imaris και Icy.
Για τους χρήστες του ΕΙΠ:
Το πρόγραμμα για τη χρήση των μικροσκοπίων ξεκινά το μεσημέρι της Τετάρτης κάθε εβδομάδας και ισχύει για την επόμενη εβδομάδα. Ο μέγιστος χρόνος χρήσης του κάθε μικροσκοπίου ανά εβδομάδα είναι 4 ώρες/ χρήστη, για μέγιστο αριθμό δύο δίωρων sessions την εβδομάδα.
Για εξωτερικούς χρήστες:
Δέσμευση του μικροσκοπίου γίνεται με τηλεφωνική επικοινωνία με την τεχνικό της Mονάδας, με συμβολική χρέωση ανά ώρα χρήσης.
Εκπαίδευση χρηστών:
Κάθε νέος χρήστης των συστημάτων μικροσκοπίας καθώς και των λογισμικών για ανάλυση εικόνας πρέπει:
- Να ενημερωθεί για τους κανόνες κράτησης και τις βασικές αρχές χρήσης των συστημάτων, καθώς και τις δυνατότητες που παρέχουν για τις συγκεκριμένες εφαρμογές που τον ενδιαφέρουν.
- Nα εκπαιδευτεί από την υπεύθυνη τεχνικό της Μονάδας στη χρήση του συστήματος που τον ενδιαφέρει και κατά τις τρεις πρώτες φορές που θα χρησιμοποιήσει το συγκεκριμένο σύστημα και μέχρι να εξοικειωθεί με τη χρήση του να πραγματοποιεί τις συνεδρίες με τη βοήθεια/ παρουσία της υπεύθυνης τεχνικού
- Οι νέοι χρήστες της Μονάδας καθώς και οι παλαιότεροι χρήστες που ξεκινούν ένα νέο project πρέπει να υποβάλλουν μία περίληψη του project στη ΜΒ.
Δημοσιεύσεις:
Στις ερευνητικές εργασίες που δημοσιεύονται και περιλαμβάνουν αποτελέσματα με τη χρήση των μικροσκοπίων ή/και προγραμμάτων ανάλυσης εικόνων της ΜΒ του ΕΙΠ, πρέπει να αναγνωρίζεται στα acknowledgments η βοήθεια και η υποστήριξη από τη ΜΒ. Αντίγραφο της δημοσίευσης σε PDF θα πρέπει να αποστέλλεται στη ΜΒ.
- ImageJ/Fiji macro workshop (6-10/05/2019)
Το σεμινάριο διάρκειας 5 ημερών διοργανώθηκε στο Ελληνικό Ινστιτούτο Παστέρ στην Αθήνα, σε συνεργασία με την πλατφόρμα Image Analysis hub του Ινστιτούτου Παστέρ Παρισίων. Στόχος του σεμιναρίου ήταν να παρέχει θεωρητική και πρακτική εκπαίδευση σε μεθόδους ανάλυσης εικόνας και αυτοματοποίησης χρησιμοποιώντας τη γλώσσα προγραμματισμού macro και το πρόγραμμα ανοιχτού κώδικα Fiji.
Το πρόγραμμα του σεμιναρίου περιλάμβανε ομιλίες και πρακτική εκπαίδευση στις βασικές γνώσεις του ImageJ/Fiji, ανίχνευση αντικειμένων (segmentation), machine learning με τη χρήση της εφαρμογής WEKA του Fiji και του προγράμματος Ilastik, ανάλυση της παρακολούθησης σωματιδίων με την εφαρμογή Trackmate του Fiji, γλώσσα προγραμματισμού ImageJ Macrο, μαζική επεξεργασία εικόνων με τη χρήση macros και προηγμένος προγραμματισμός σε γλώσσα macrο, ενώ η τελευταία ημέρα του σεμιναρίου ήταν αφιερωμένη στην ανάλυση εικόνων των εκπαιδευομένων και στην εφαρμογή των νέων γνώσεων που απέκτησαν.
Οι εκπαιδευτές ήταν οι Dmitry Ershov και Sébastien Herbert από την πλατφόρμα Image Analysis hub του Ινστιτούτου Παστέρ Παρισίων. Οι εκπαιδευόμενοι ήταν 5 επιστήμονες από το Ελληνικό Ινστιτούτο Παστέρ (4 εκ των οποίων μέλη του προγράμματος BIOIMAGING-GR) και 3 εξωτερικοί επιστήμονες από το Πανεπιστήμιο και άλλα ερευνητικά κέντρα στην Αθήνα.
Με την υποστήριξη:
Του προγράμματος BIOIMAGING-GR «Ελληνική Ερευνητική Υποδομή για την Aπεικόνιση και Παρακολούθηση Θεμελιωδών Διεργασιών στη Βιολογία και την Ιατρική» και του Ελληνικού Ινστιτούτου Παστέρ.

- «REVEALING LIFE’S HIDDEN SECRETS THROUGH NEW TECHNOLOGY» Leica workshop (5-6/06/2018)
Το σεμινάριο διάρκειας 2 ημερών διοργανώθηκε στο Ελληνικό Ινστιτούτο Παστέρ στην Αθήνα, με την υποστήριξη της Leica Microsystems, του προγράμματος Bioimaging-GR και του Ελληνικού Ινστιτούτου Παστέρ. Στόχος του σεμιναρίου ήταν να παρέχει θεωρητική και πρακτική εκπαίδευση σε προηγμένες εφαρμογές της μικροσκοπίας σε επιστήμες ζωής με έμφαση στη μικροσκοπία 2 φωτονίων και στη συνεστιακή μικροσκοπία φθορισμού μέσω:
- Διαλέξεων από εκπαιδευτές της Leica Microsystems και Έλληνες ερευνητές
- Πρακτικής εκπαίδευσης στη χρήση συνεστιακών μικροσκοπίων
- Συζητήσεων με τους ειδικούς στο ευρύτερο πεδίο της μικροσκοπίας
35 εκπαιδευόμενοι ακολούθησαν το θεωρητικό και το πρακτικό μέρος, ενώ ένας αριθμός συμμετεχόντων παρακολούθησε μόνο το θεωρητικό μέρος του σεμιναρίου.

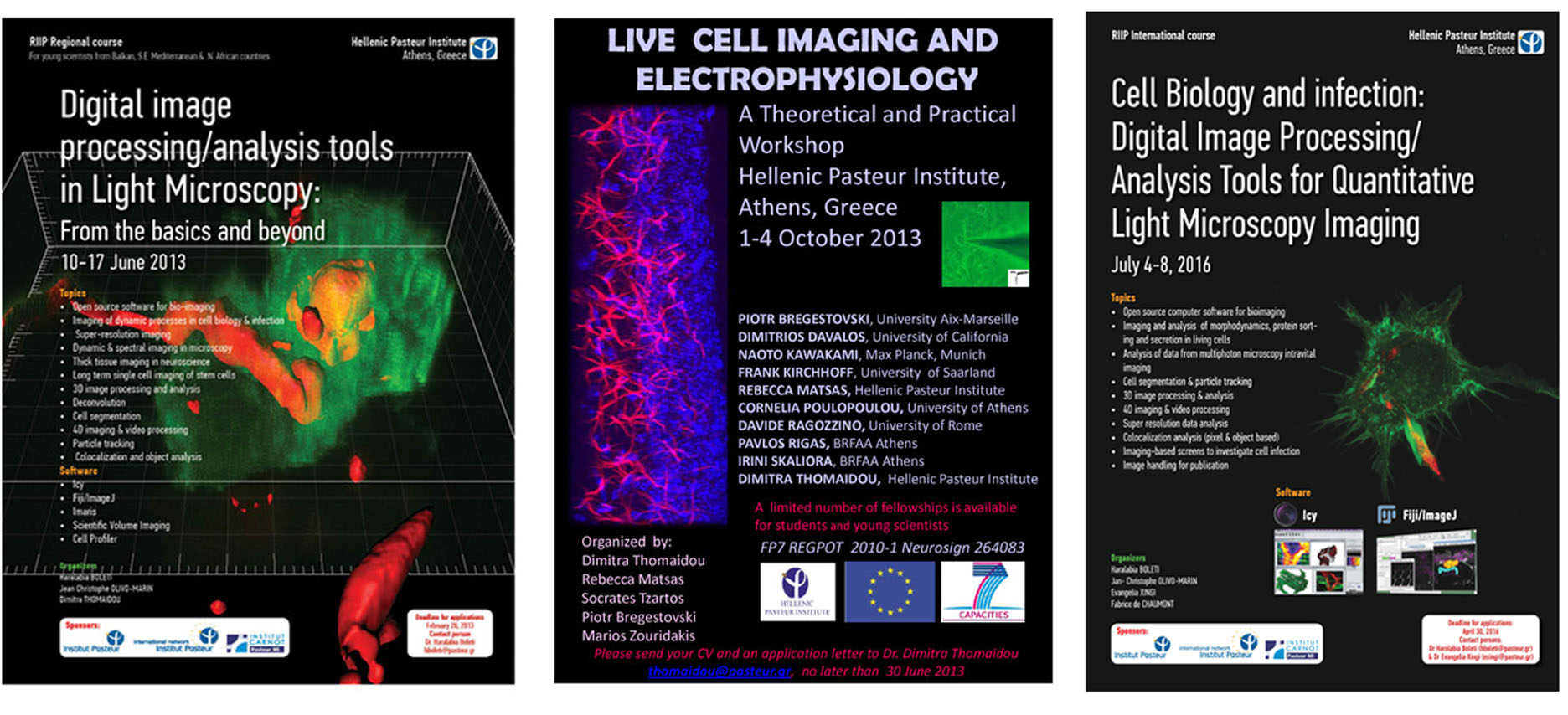
- RIIP International course “Cell biology and Infection: Digital Image processing/Analysis tools for quantitative light microscopy imaging” (4-8/07/2016)
Το σεμινάριο διάρκειας 5 ημερών διοργανώθηκε στο Ελληνικό Ινστιτούτο Παστέρ στην Αθήνα το διάστημα 4-8 Ιουλίου 2016, με στόχο την παροχή θεωρητικής και πρακτικής εκπαίδευσης σε μεθόδους ανάλυσης ψηφιακής εικόνας και εξαγωγής αποτελεσμάτων., Το πρόγραμμα του σεμιναρίου περιλάμβανε:
• Διαλέξεις εστιασμένες στις μεθόδους και νέους αλγόριθμους/προγράμματα για την Επεξεργασία/Ανάλυση Ψηφιακών δεδομένων με Μικροσκοπία Φωτός (εικόνες και βίντεο) και επιλεγμένα θέματα Κυτταρικής Βιολογίας και Βιολογίας του παθογόνου ξενιστή αλληλεπίδρασης.
• Πρακτικές συνεδρίες υπολογιστή σχετικά με την ποσοτική ανάλυση των συνόλων δεδομένων εικόνων μικροσκοπίας με χρήση του λογισμικού ανοιχτού κώδικα Icy και ImageJ/Fiji
• Άτυπες συζητήσεις και σεμινάρια με ειδικούς στον τομέα
- European FP7 Regpot-2010 ‘Neurosign’ theoretical and practical workshop “Live Cell Imaging and Electrophysiology” (1-4/10/2013)
Το σεμινάριο διεξήχθη το διάστημα 1-4 Οκτωβρίου 2013 στο Ελληνικό Ινστιτούτο Παστέρ στην Αθήνα. Στόχος του σεμιναρίου ήταν να παράσχει στους μεταπτυχιακούς και μεταδιδακτορικούς επιστήμονες εννοιολογική και πρακτική κατανόηση της απεικόνισης ζωντανών κυττάρων του Κεντρικού Νευρικού Συστήματος σε επίπεδο ολόκληρου ζωντανού πειραματόζωου (whole animal imaging), καθώς και της ηλεκτροφυσιολογίας.
Κατά τη διάρκεια των πρακτικών ασκήσεων, οι 20 επιλεγμένοι συμμετέχοντες είχαν την ευκαιρία να παρακολουθήσουν τα εξής πειράματα:
- χειρουργική επέμβαση σε ποντίκια για τη δημιουργία και εγκατάσταση κρανιακού «παραθύρου» και «παραθύρου» στον νωτιαίο μυελό,
- intravital Multiphoton απεικόνιση
- πειράματα ηλεκτροφυσιολογίας με καταγραφές σημάτων από μεμονωμένα κύτταρα θηλαστικών, χρησιμοποιώντας την τεχνική patch-clamp.
Η χρηματοδότηση χορηγήθηκε από το FP7 REGPOT 2010-1 EC Πρόγραμμα «NeuroSign» που στοχεύει στην ίδρυση Κέντρου Αριστείας για τη μελέτη της Νευροσήμανσης κατά τη λειτουργία και τη δυσλειτουργία του νευρικού συστήματος στο Ελληνικό Ινστιτούτο Παστέρ.
- RIIP Regional Course “Digital image processing/ analysis tools in Light Microscopy: From the basics and beyond” (10-17/6/ 2013)
Το 8ήμερο σεμινάριο διοργανώθηκε στο Ελληνικό Ινστιτούτο Παστέρ στην Αθήνα, το διάστημα 10-17 Ιουνίου 2013. Στόχος του σεμιναρίου ήταν η παροχή θεωρητικής και πρακτικής εκπαίδευσης σε μεθόδους ανάλυσης ψηφιακής εικόνας και στη χρήση λογισμικών ανοιχτού κώδικα και εμπορικών για την ποσοτική αξιολόγηση δεδομένων μικροσκοπίας φθορισμού μέσω:
-
- Διαλέξεων
- Hands –on πρακτικών εκπαιδευτικών συνεδριών με δεδομένα μικροσκοπίας των συμμετεχόντων ή δεδομένα που παρέχονται από τους εκπαιδευτές.
- Άτυπων συζητήσεων και σεμιναρίων με ειδικούς στον τομέα.
- Πρακτικών συνεδριών στα ακόλουθα λογισμικά ανάλυσης εικόνας: Imaris, Scientific Volume Imaging (SVI), Image J/Fiji, Icy bioimage analysis, Cell profiler και Timm’s Tracking Tool.
|
Οι Επιστήμονες που υποστηρίζουν τη ΜΒ του ΕΙΠ έχουν συμμετάσχει είτε ως μέλη είτε ως επιστημονικοί υπεύθυνοι σε αρκετές αιτήσεις επιχορήγησης που κατάφεραν να προσελκύσουν χρηματοδότηση για τη ΜΒ είτε για την οργάνωση επιμορφωτικών σεμιναριακών μαθημάτων είτε για την αναβάθμιση του εξοπλισμού και την ανάπτυξη νέας μεθοδολογίας από τις ακόλουθες επιχορηγήσεις:
- International Network of Pasteur Institutes (IPIN) PTR Grant (2020-2022): “Microglia Imaging in Alzhemer’s Disease”. Scientific Responsibles: Dr. D. Thomaidou, Dr. M. Costa (Institut Pasteur Lille), Dr. J-Y. Tinevez, Institut Pasteur Paris.
- ΒΙΟΙΜAGING GR 2018-2020: “Hellenic Research Infrastructure for the Imaging and Observation of Fundamental Processes in Biology and Medicine” (MIS 5002755) which is implemented under the Action “Reinforcement of the Research and Innovation Infrastructure”, funded by the Operational Programme “Competitiveness, Entrepreneurship and Innovation” (NSRF 2014-2020) and co-financed by Greece and the European Union (European Regional Development Fund, coordinator Dr. Tavernarakis, IMBB Forth).
- Stavros Niarchos Foundations Sponsorships 2016-2020: «Development of innovative Biological products and health services for infectious and neurodegenerative diseases» (Coordinators Drs. R. Matsa and V. Myriagou)
- Ηellenic State Scholarship Foundation (Ι.Κ.Υ.) and German Burau for Academics’ Exchanges (DAAD): IKYDA program 2014-2015: Astroglia activation and reprogramming in brain injury and repair: analysis by in vivo imaging (2P-LSM) of the brain (Scientific Responsible Dr. D. Thomaidou).
- RIIP (Institut Pasteur International Network) International course 2016 :
” Cell Biology and infection: Digital Image Processing/Analysis Tools for Quantitative Light Microscopy Imaging”. Scientific Responsible Dr. H. Boleti - FP7 EU program 264083 NEUROSIGN 2010-2013: Development of Centre of Excellence in Neurosciences (cordinators. Dr.S. Tzartos– Dr. R. Matsa & Dr. L. Probert (Dr. D. Thomaidou Responsible for WP of purchasing the Infrastructure equipment for in vivo imaging).
- RIIP (Institut Pasteur International Network) Regional course 2013:
“Digital image processing/analysis tools in Light Microscopy: From the basics and beyond”. Scientific Responsible Dr. H. Boleti - Competitive grant from the Greek General Secretariat of Research and Technology in the context οφ European program “Human Networks for training in Research and Technology” 2004-2006 –Establishment of the Greek Light Microscopy Network Title: “Applications of Light Microscopy in Biomedical research and Diagnosis” In colaboration with the U. of Ioannina & U. of Crete Coordinator of the project and of the Network, HPI-LMU. (Scientific Responsible ¨Drs H. Boleti & D. Thomaidou)


